XỬ LÝ NƯỚC THẢI CÔNG NGHIỆP DỆT NHUỘM BẰNG QUÁ TRÌNH PEROXONE
Nước thải công nghiệp dệt nhuộm có độ kiềm, độ màu và hàm lượng các chất hữu cơ, tổng chất rắn rất cao do sử dụng rất nhiều loại hóa chất trong quy trình công nghệ. Trong đó, độ màu là một trong các thành phân khó xử lý nhất. Bài báo trình bày các kết quả nghiên cứu xử lý màu và COD khó phân hủy sinh học (COD trơ) của nước thải dệt nhuộm khu công nghiệp dệt may Phố Nối (Hưng Yên) bằng các quá trình oxy hóa nâng cao (Advanced Oxidation Processes - AOPs) trên cơ sở ozone là quá trình Peroxone ở cấp độ thử nghiêm trên hệ thống Pilot Study đã đạt kết quả, có thể nghiên cứu đề nâng lên quy mô sản xuất thực tế.
Xử Lý Nước Thải Công Nghiệp Dệt Nhuộm Bằng Quá Trình Peroxone
1.Đặt vấn đề:
Nước thải công nghiệp dệt nhuộm gồm có các chất ô nhiễm chính: Các tạp chất tách ra từ vải sợi như dầu mỡ, các hợp chất chứa nitơ, pectin, các chất bụi bẩn dính vào sợi; Các hóa chất sử dụng trong quy trình công nghệ như hồ tinh bột, H2SO4, CH3COOH, NaOH, NaOCl, H2O2,Na2CO3, Na2SO3... các loại thuốc nhuộm, các chất trợ, chất ngấm, chất cầm màu, chất tẩy giặt. Lượng hóa chất sử dụng tùy thuộc loại vải, màu và chủ yếu đi vào nước thải của các công đoạn sản xuất.
Nước thải dệt nhuộm luôn dao động rất lớn về lưu lượng và tải lượng ô nhiễm, thay đổi theo mùa, theo loại hàng sản xuất và chất lượng sản phẩm. Tuy nhiên, các đặc trưng ô nhiễm của nước thải công nghiệp dệt nhuộm ở Việt Nam gồm: pH = 9,0 - 11,0; BOD = 90 - 220 mg/L; COD = 570 - 1200 mg/L; TSS = 800 - 1100 mg/L; Độ màu= 1000- 1600 (Pt-Co).
Hiện nay, công nghệ xử lý nước thải dệt nhuộm, về cơ bản qua các bước sau: Tách rác
- Xử lý hóa học - Xử lý hóa lý - Xử lý sinh học -Hấp phụ bằng than hoạt tính - Khử trùng - Xả ra nguồn tiếp nhận.
Các phương pháp hóa học, hóa lý truyền thống để xử lý nước thải dệt nhuộm là trung hòa điều chỉnh pH, đông keo tụ, hấp phụ, oxy hóa. Tuy nhiên, độ màu và một số chất hữu cơ khó phân hủy sinh học trong nước thải dệt nhuộm rất khó xử lý, gây màu tối cho nguồn tiếp nhận, ảnh hưởng tới quá trình quang hợp của các loài thủy sinh, ảnh hưởng xấu tới cảnh quan.
Chúng tôi nghiên cứu áp dụng các quá trình oxy hóa nâng cao trên cơ sở ozone để xử lý độ màu và COD khó phân hủy sinh học của nước thải dệt nhuộm khu công nghiệp dệt may Phố Nối (Hưng Yên) thuộc Tập đoàn Dệt may Việt Nam.
2. Cơ sở nghiên cứu
Căn cứ các thông số đặc trưng ô nhiễm thực tế của nước thải dệt nhuộm khu công nghiệp dệt may Phố Nối (Hưng Yên) và Quy chuẩn Việt Nam QCVN
13:2008/BTNMT - Quy chuẩn kỹ thuật quốc gia về nước thải của công nghiệp dệt
may để nghiên cứu quy trình xử lý màu và COD trơ của nước thải đạt kết quả tốt nhất.
Cơ sở khoa học để nghiên cứu là các quá trình oxy hóa nâng cao và ứng dụng trong công nghệ xử lý nước và nước thải trên thế giới và Việt Nam.
Quá trình oxy hóa nâng cao
Các quá trình oxy hóa nâng cao AOPs là một trong những công nghệ cao được phát triển trong khoảng 20 năm trở lại đây. AOPs là những quá trình phân hủy oxy hóa dựa vào các gốc tự do hoạt động hydroxyl *OH được tạo ra "in situ" ngay trong quá trình xử lý.
Gốc *OH là một tác nhân oxy hóa mạnh nhất trong các tác nhân oxy hóa từ trước tới nay, có khả năng oxy hóa không lựa chọn với mọi hợp chất hữu cơ, cả những chất khó phân hủy hoặc không phân hủy sinh học, biến chúng thành những hợp chất vô cơ như CO2, H2O, các axit vô cơ...
Các tác nhân oxy hóa thông thường như H2O2, O3, có thể nâng cao khả năng oxy hóa của chúng bằng các phản ứng hóa học khác nhau để tạo gốc *OH, thực hiện quá trình oxy hóa gián tiếp thông qua gốc *OH.
Dưới đây là một số quá trình oxy hóa nâng cao được ứng dụng trong công nghệ xử lý nước và nước thải.
Quá trình Fenton
Quá trình Fenton (hay phản ứng Fenton) là phản ứng giữa ion Fe2+với H2O2 sinh ra các gốc tự do *OH, còn Fe2+ bị ion hóa thành Fe3+.
Fe2+ + H207 -> Fe3+ + *OH + OH-GỐC *OH oxy hóa các chất hữu cơ khó phân hủy sinh học, phân hủy chúng thành các chất vô cơ hoặc các chất có phân tử lượng thấp hơn, có khả năng phân hủy sinh học.
Theo phương trình (1), phải có ion Fe2+ để tạo ra gốc *OH, trong điều kiện pH thấp mới tồn tạiion Fe2+, hiệu quả nhất là pH ≈ 3, còn trong điều kiện pH cao sẽ tạo thành Fe3+ và kết tủa Fe(OH)3 (phương trình 2), phản ứng Fenton sẽ xảy ra rất chậm. Fe3+ + 3OH- -> Fe(OH)3 (2)
Quá trình Peroxone
Quá trình oxy hóa của ozone vói sự có mặt của H2O2 được gọi là quá trình Peroxone hoặc Perozone. Sự khác nhau giữa quá trình Ozone và Peroxone là ở quá trình Ozone thực hiện oxy hóa các chất ô nhiễm trực tiếp bằng phân tử O3 trong nước, còn quá trình Peroxone thực hiện oxy hóa chất ô nhiễm gián tiếp thông qua gốc *OH.
Cơ chế phản ứng tạo gốc *OH từ hệ O3/H2O2 theo phương trình (3). H202 + 3O3 -> 2 *OH + 3O2 (3)
Phản ứng (3) cho thấy, quá trình Peroxone có thể tiến hành trong điều kiện pH trung tính. Hiệu quả phân hủy các chất ô nhiễm hữu cơ của hệ O3/H2O2 cao hơn nhiều so với tác dụng oxy hóa của O3 đơn vì có tác nhân *OH được sinh ra trong quá trình phản ứng.
Quá trình Cataione đồng thể
Quá trình Catazone là quá trình đưa vào hệ O3/H2O2 các chất xúc tác để nâng cao hoạt tính oxy hóa của ozone.
Chất xúc tác kiềm:
Cơ chế tạo gốc tự do hydroxyl *OH trong môi trường nước vói chất xúc tác kiềm OH- như sau [4]:
H2O2 + 3O3 → 2*OH + 3O2 (4)
Chất xúc tác kim loại
Cho vào hệ O3/H2O2 các lon kim loại chuyển tiếp có tác dụng nâng cao hoạt tính oxy
hóa của ozone.
Đối với xúc tác sắt Fe2+: Cho vào hệ O3/H2O2 dung dịch FeSO4 sẽ tạo gốc *OH và
tạo thànhFe3+. Trong trường họp này Fe2+ là chất tham gia phản ứng và bị tiêu hao trong quá trình phản ứng: H2O2 + 3O3 -» 2 * OH + 3O2 (5)
Đối với xúc tác nhôm Al3+: Cho vào hệ dung dịch phèn nhôm Ab(SO4)3. Cơ chế phản ứng có thể như sau: Trong môi trường nước, Al3+ tạo thành Al(OH)3 kết tủa và các bông keo này hấp phụ một phần COD và chất màu trong nước, làm nồng độ COD cao hơn trong nước. Khi có O3kết hợp với H2O2 sẽ tạo ra gốc *OH và xảy ra phản ứng phân hủy chất hữu cơ trong nước, do trong các bông keo có nồng độ chất hữu cơ rất cao nên tốc độ phản ứng tăng mạnh, giảm nồng độ chất hữu cơ và tiếp tục quá trình hấp phụ chất hữu cơ vào bông keo và quá trình phân hủy COD và màu nước thải tiếp diễn.
Quá trình Cataione dị thể
Quá trình Catazone dị thể là quá trình đưa vào hệ O3/H2O2 các chất xúc tác rắn là các oxit kim loại chuyển tiếp hoặc than hoạt tính.
Cơ chế quá trình Cataione xúc tác dị thể
Theo Legube et ai. (1999), cơ chế phản ứng Catazon dị thể có thể xảy ra theo 2 khả năng sau đây:
+ Chất xúc tác chỉ đóng vai trò như một chất hấp phụ Me-OH, ozone và gốc hydroxyl tạo ra từ sự phân huy ozon sẽ là tác nhân oxy hóa.
+ Chất xúc tác có thể tác dụng vói cả ozon và chất hữu cơ hấp phụ trên bề mặt, đúng nghĩa với bản chất của quá trình xúc tác.
Lựa chọn quá trình AOPs thích hợp để xử lý nước thải dệt nhuộm
Với đặc trưng ô nhiễm của nước thải dệt nhuộm là có độ màu cao và COD khó phân hủy sinh học, độ pH = 9 - 11, chúng tôi lựa chọn quá trình AOPs trên cơ sở ozone là Peroxone để nghiên cứu xử lý nước thải dệt nhuộm.
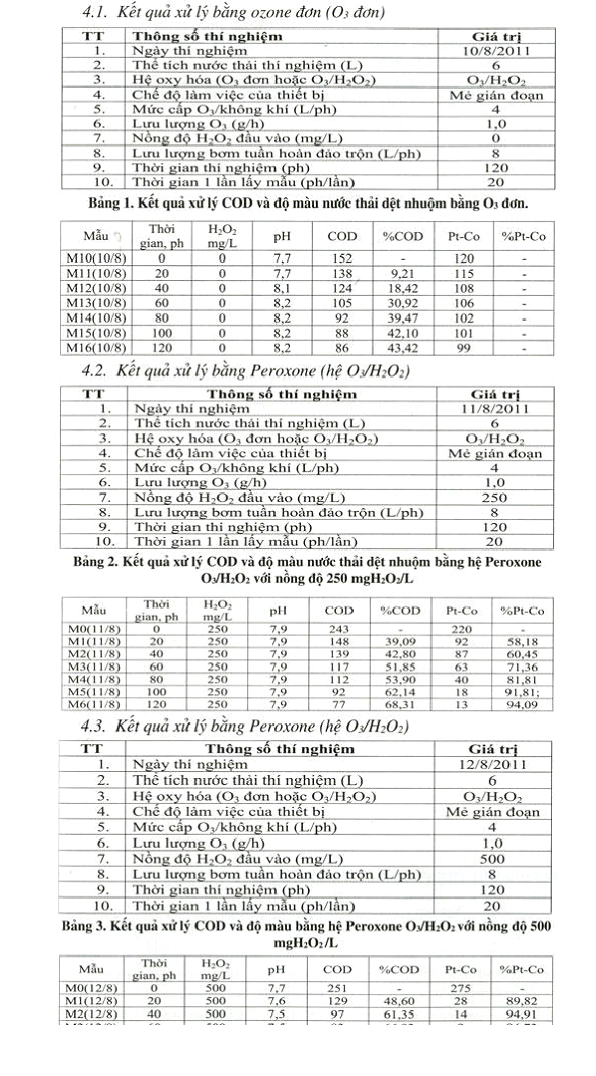
- Tiến hành thí nghiệm
- Chuẩn bị thí nghiệm
Nước thải đầu vào để thí nghiệm lấy tại bể điều hòa trạm xử lý nước thải khu công nghiệp dệt may của Tập đoàn Dệt - May Việt Nam tại Phố Nối (Hưng Yên).
- Hóa chất
- Khoa học và Công nghệ môi trường (ĐHBK Hà Nội) chế tạo.
- Phương pháp và thiết bị phân tích
Phân tích kết quả thí nghiệm tại phòng thí nghiệm Nghiên cứu và phát triển công nghệ môi trường -Viện Khoa học và Công nghệ Môi trường (ĐHBK Hà Nội). pH xác định theo TCVN 6492:1999, thiết bị đo pH meter - USA; COD xác định theo TCVN 6491:1999, thiết bị DRB 200 - USA; Độ màu xác định theo TCVN 6185:1996, thiết bị Quang phổ kế UV - vis Perkin Elmer.
- Trình tự quá trình thí nghiệm
+ Xử lý sơ bộ nước thải dệt nhuộm bằng quá trình keo tụ
Keo tụ nước thải dệt nhuộm bằng PAC và Polymer C với chế độ như sau:
+ Thể tích mẫu keo tụ : 20 lít
+ Nồng độ chất keo tụ: 5 gPAC/L
+ Nồng độ chất trợ keo tụ: 3 ml Polymer C/L




 1
1
 2
2
 3
3








